Cet article technique aborde la contamination ferreuse des aciers inoxydables, la corrosion galvanique, les mécanismes, la prévention et le guide des bonnes pratiques dans les ateliers.
1 - Introduction
La contamination ferreuse d'un acier inoxydable résulte d'une corrosion galvanique entre des particules de fer d'un acier carbone déposées fortuitement sur la surface d'un acier inoxydable.
Pour se faire, il faut la présence de trois éléments, la présence de poussières ou particules de fer, la surface d'une pièce en acier inoxydable et une solution d'électrolyte comme l'humidité ambiante par exemple.
La pollution ferreuse ou contamination ferreuse est une corrosion des aciers inoxydables causée par la destruction de la couche superficielle d'oxyde de chrome. Elle résulte généralement de l'utilisation d'outils qui ne sont pas correctement nettoyés ou qui ne sont pas en acier inoxydable. Cette contamination survient lors de l'usinage, du meulage, de la mise en forme, du soudage ou du nettoyage.

2 - Mécanisme de la contamination ferreuse
Lorsque des particules ferreuses de la poussière et de projections incandescentes de meulage se déposent sur une surface de pièce en acier inoxydable et que l'atmosphère ambiante est suffisamment humide pour jouer le rôle
d'électrolyte, il se déclenche une corrosion galvanique au contact.
Les particules ferreuses de petite taille qui jouent le rôle d'anode projetées ou déposées sur une surface d'acier inoxydable qui joue le rôle de cathode se corroderont d'autant plus rapidement que la différence de surface des deux matériaux est importante. Ces poussières ferreuses combinées à l'électrolyte se transformeront en oxydes de fer (rouille) qui vont altérer progressivement la couche passive d'oxyde de chrome de l'acier inox.
L'acier inoxydable sensibilisé par les particules ferreuses corrodées, présentera un défaut de continuité de sa couche protectrice d'oxyde de chrome pouvant engendrer de la corrosion par piqûration.
Il s'établit alors un couple entre les zones discontinues qui vont constituer des petites anodes où a lieu la dissolution du métal et le reste de la surface où se produit la réaction cathodique.
Les aciers inoxydables sont particulièrement sensibles à la corrosion par piqûres.
Il est donc impératif de prévenir dans les ateliers et sur chantier la contamination ferreuse des aciers inoxydables par tous les moyens.

3 - Comment éviter ou limiter la contamination ferreuse
Il faut pour éviter la contamination ferreuse :
[LIST=1]
[*]Utiliser des procédures de fabrication, de montage et de contrôle adéquates
[*]Utiliser des outils exclusivement dédiés au travail de l'inox et parfaitement nettoyés avant le travail de l'inox.
[*]Utiliser pour le tronçonnage, le meulage et le polissage que des produits affectés à l'inox et spécifiques
à l'inox
[*]Nettoyer systématiquement les équipements de manutention en contact avec les tôles en acier inoxydable
[*]Nettoyer les pièces inoxydables avec des chiffons propres spécifiques à l'inox
[*]Brosser les soudures et pièces inoxydables avec des brosses à poils inox spécifiques à l'inox
[*]Ne jamais meuler de l'acier carbone et travailler de l'acier carbone à proximité d'équipements en acier inoxydable
[*]Séparer physiquement les ateliers acier carbone et les ateliers acier inox (atelier blanc ou salle blanche)
[*]Mettre des protections surfaciques sur chaque équipement en acier inoxydable
[*]Utiliser de préférence des tôles et des tubes revêtus d'un film plastique adhésif pelable
[*]Conserver les protections surfaciques comme les films plastiques adhésifs pelables le plus longtemps possibles
[*]Réaliser un traitement de décapage au moyen d'une solution d'acide sulfurique suivi par un traitement de passivation au moyen d'une solution d'acide nitrique ou acide phosphorique pour éliminer la présence éventuelle de particules ferreuses suivi d'un rinçage à l'eau déminéralisée ou eau claire et d'un essuyage
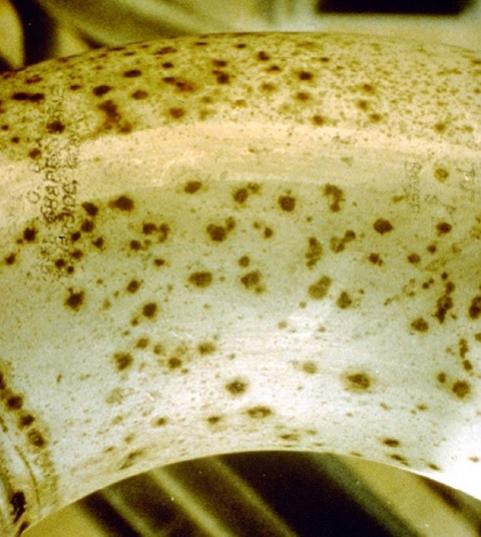
4 - Comment stopper la contamination ferreuse
Il faut, pour stopper la contamination ferreuse, préférer faire un traitement chimique plutôt qu'un traitement abrasif de la surface. La combinaison des deux techniques de traitement abrasif suivi d'un traitement chimique peut être favorable.
La corrosion des particules ferreuses apparaît rapidement en quelques jours.
Dès l'observation des traces et points de rouille sur la surface de l'acier inoxydable, il faut nettoyer la surface avec de l'eau déminéralisée avec une éponge propre suivi d'un rinçage soigné et d'un essuyage.
Enfin pratiquer un traitement de passivation.
Si la contamination ferreuse est relativement ancienne et prononcée, il est obligatoire de décaper avec une solution d'acide sulfurique puis de passiver la surface d'inox avec une solution d'acide nitrique ou phosphorique suivi d'un rinçage à l'eau déminéralisé ou d'eau claire et d'un essuyage.
Interdire l'usage de solutions chlorées et de produits chlorés sur les aciers inoxydables.
5 - L'échelle galvanique des métaux
En présence d'une solution d'électrolyte (humidité, eau de mer, solution aqueuse, etc..), si deux métaux sont en contact (clinchage, placage, rivetage, soudage, vissage?) ou à proximité proche, du fait de leur différence de potentiel, il s'établit entre les deux matériaux un courant électrique par différence de potentiel : on dit que l'on a formé un couple galvanique.
Le métal le moins noble, celui qui présente le potentiel électrique de dissolution le moins élevé dans l'échelle de la série galvanique considérée joue le rôle d'anode (polarité +) et se dissout ou se corrode.
L'autre métal joue le rôle de cathode (polarité -) et reste protégé.
Le courant électrique s'écoule de l'anode vers la cathode.
Ce phénomène correspond au mécanisme de la corrosion galvanique ou corrosion de contact.
Les aciers inoxydables présentent comparativement aux autres métaux des potentiels élevés et comme dans la plupart des cas ils se trouvent en contact avec des matériaux moins ?nobles' (acier galvanisé ou acier carbone par exemple) ils encourent peu de risques de se corroder.
Donc la corrosion galvanique n'affecte anodiquement pas les aciers inoxydables mais plutôt les autres matériaux avec lesquels ils sont en contact.
La différence de potentiel indique le sens de la menace, mais pas son ampleur, ce n'est donc pas le seul facteur à prendre en compte.
La conduction électrique du milieu, la température sont aussi des facteurs importants.
Pour qu'il y ai un effet de pile et donc de corrosion galvanique, il faut au moins 100 mV (millivolt) de différence entre les 2 métaux en présence.
Plus la différence entre les métaux est importante, plus la réaction de pile sera forte.
Les métaux les plus nobles qui ont le potentiel de dissolution le plus élevé deviennent cathode provoqueront la destruction des métaux les moins nobles.
L'échelle galvanique est la suivante :
Carbone, platine, or et argent aux environs de + 200 mV
Hastelloy C (62% Ni-18% Cr-18% Mo) Incoloy 825 (42% Ni-20% Cr-3% Mo) aux environs de 0 mV
Inox 304 ou 316 passivé de - 50 à - 80 mV
Cuivre, bronze, bronze d'alu de - 200 à - 360 mV
Inox 304 ou inox 316 actif - 400 à - 500 mV
Plomb - 510 mV
Acier ? Fonte - 610 mV
Aluminium et alliages d'alu - 850 à - 750 mV
Zinc - 1130 mV
Magnésium - 1600 mV
6 - Comment prévenir la corrosion galvanique des métaux
Lorsque le bureau d'études a fait le choix d'utiliser des matériaux métalliques différents, il est possible de diminuer, voire d'éliminer les risques de corrosion galvanique.
La vitesse de dissolution de l'anode étant fonction de la surface de la cathode, on recherchera un rapport de surface anode/cathode aussi grand que possible.
Dans la mesure du possible, sélectionner des métaux très proches les uns des autres dans l'échelle galvanique ci-dessus.
Lorsque la différence de potentiel libre n'excède pas les 50mV dans le milieu considéré, la corrosion galvanique est
négligeable pour des surfaces de matériaux quasi-identiques.
Isoler les deux métaux dissemblables par des joints, des entretoises, de la peinture? (matériaux non conducteurs de l'électricité)
Mettre en place des parties anodiques facilement remplaçables ou les concevoir plus épaisses pour assurer une plus grande durée de vie de l'installation.
Utiliser des inhibiteurs de corrosion.
7 - Quelques liens Internet utiles
8 - Vos commentaires et réactions sur cet article
Vous avez la possibilité de commenter cette page, de réagir ou de compléter les informations en rédigeant un message dans le cadre ci-dessous intitulé Ecrire un commentaire
Nous vous remercions par avance de votre sollicitude et de votre aide pour l'amélioration des données techniques du site.
Nous rappelons à nos aimables visiteurs que nos ressources techniques et nos croquis ne peuvent être ni copiés ni utilisés sans autorisation écrite de notre part.
Par: Dominique ADMIN